マンジャロ®︎皮下注(成分名: チルゼパチド )は2型糖尿病に保険適応のある注射剤で、2023年4月に販売が開始されました。
海外では同じチルゼパチドでも肥満症治療薬として「ゼップバウンド ®︎」もすでに販売されています。
従来の持続型GLP-1受容体作動薬と異なり、GIP受容体にも作用することを特長とした新しい薬剤です。
今回の記事では、チルゼパチド(マンジャロ®︎、ゼップバウンド®︎)の化学構造と特徴について解説します!
インクレチンとインスリン
インクレチンにはGIP(グルコース依存性インスリン分泌刺激ポリペプチド−1)とGLP−1(グルカゴン様ペプチド−1)があり、いずれもグルコース依存的にインスリンの分泌を促すホルモンです。
また、インスリンはヒト体内で唯一血糖値を下げるホルモンであり、インスリンが働かないと血糖値が過剰に高まってしまいますが、逆にインスリンが働き過ぎると血糖値は下がり過ぎてしまいます。
糖(グルコース)自体はヒトにとって重要な生命活動のエネルギー源であるため、低過ぎても生命を脅かします。
したがって、体内に入る糖の量に応じて分泌されるインスリンの量をコントロールできれば、血糖値が高くなり過ぎたり低くなり過ぎることなく維持できることになり、その役割を担っているのが「インクレチン」です。
GIPとGLP–1
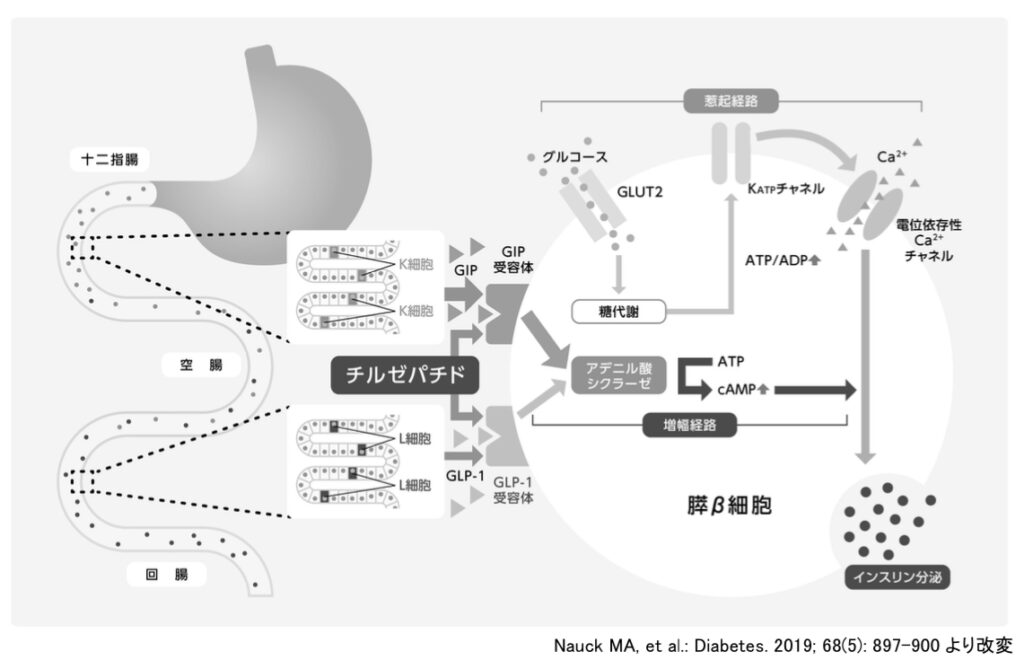
GIPとGLP−1の作用機序も確認しておきましょう。
GIPとGLP−1は血糖値を下げる機序が似ています。
それぞれGタンパク質共役型受容体であるGIP受容体(GIPR)とGLP−1受容体(GLP−1R)に結合しアデニル酸シクラーゼを活性化します。
活性化したアデニル酸シクラーゼはATPをcAMPに変換し、cAMPはEpac(Exchange protein activated by cAMP)やPKA(protein kinase A)を活性化します。
これらによって細胞内Ca2+濃度が上昇しインスリン分泌を増強します。
インクレチンとDPP–4
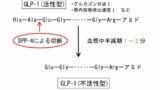
インクレチンはDPP-4という酵素によって切断され不活性化します。
そこで、インクレチンの分解を持続的に抑制しグルコース濃度依存的に血糖を下げるため開発されたのがDPP-4阻害薬です。
DPP-4阻害薬とGLP-1受容体作動薬を併用しないのは、GLP-1受容体を活性化する意味で作用が共通していることと、両者を併用した際の臨床試験成績がなく有効性および安全性が確認されていないため、とされています。
DPP-4阻害薬の化学構造と特徴については過去記事もご参照ください。
↓↓
【DPP-4阻害薬の化学構造とファーマコフォア】結合様式によるクラス分けと比較!
チルゼパチド ( マンジャロ ®︎)の化学構造と特徴
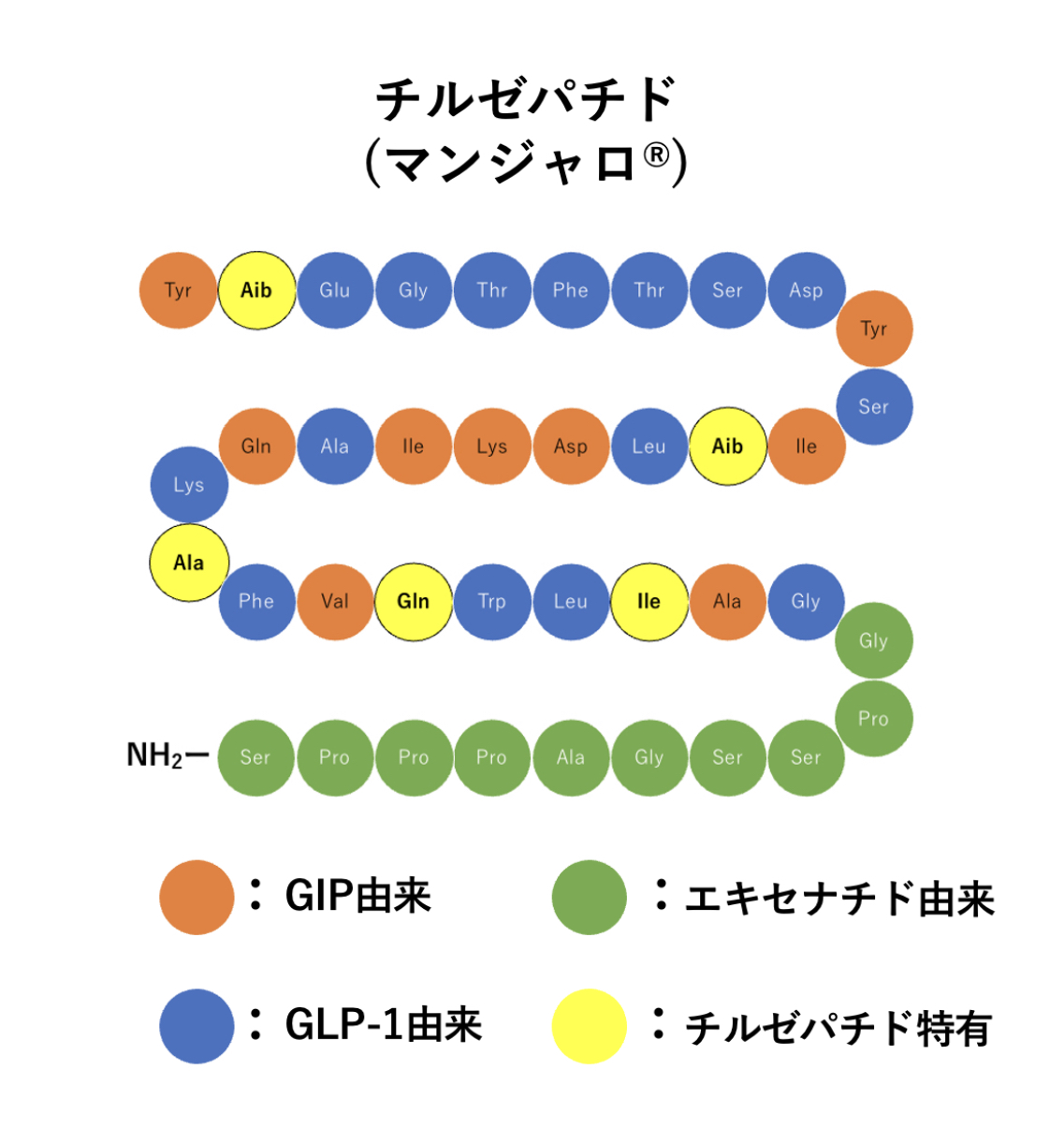
チルゼパチドは39個のアミノ酸から構成されるペプチドで、GIPのアミノ酸配列をもとに設計されていながらGLP–1受容体にも作用するよう工夫された製剤です。
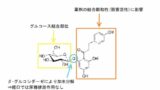
Lys20にC20脂肪酸側鎖を付加することでアルブミンに結合しやすく、安定性の向上と半減期の延長を実現しています。
チルゼパチド のアミノ酸配列
チルゼパチドのアミノ酸配列はとても凄いです!
GIPのアミノ酸配列をもとにし、GLP-1受容体にも作用するようGLP-1とエキセナチド(バイエッタ®︎)由来のアミノ酸を残し、そのうえ構造活性相関でベターなアミノ酸を置換導入しています。(すごいです笑)
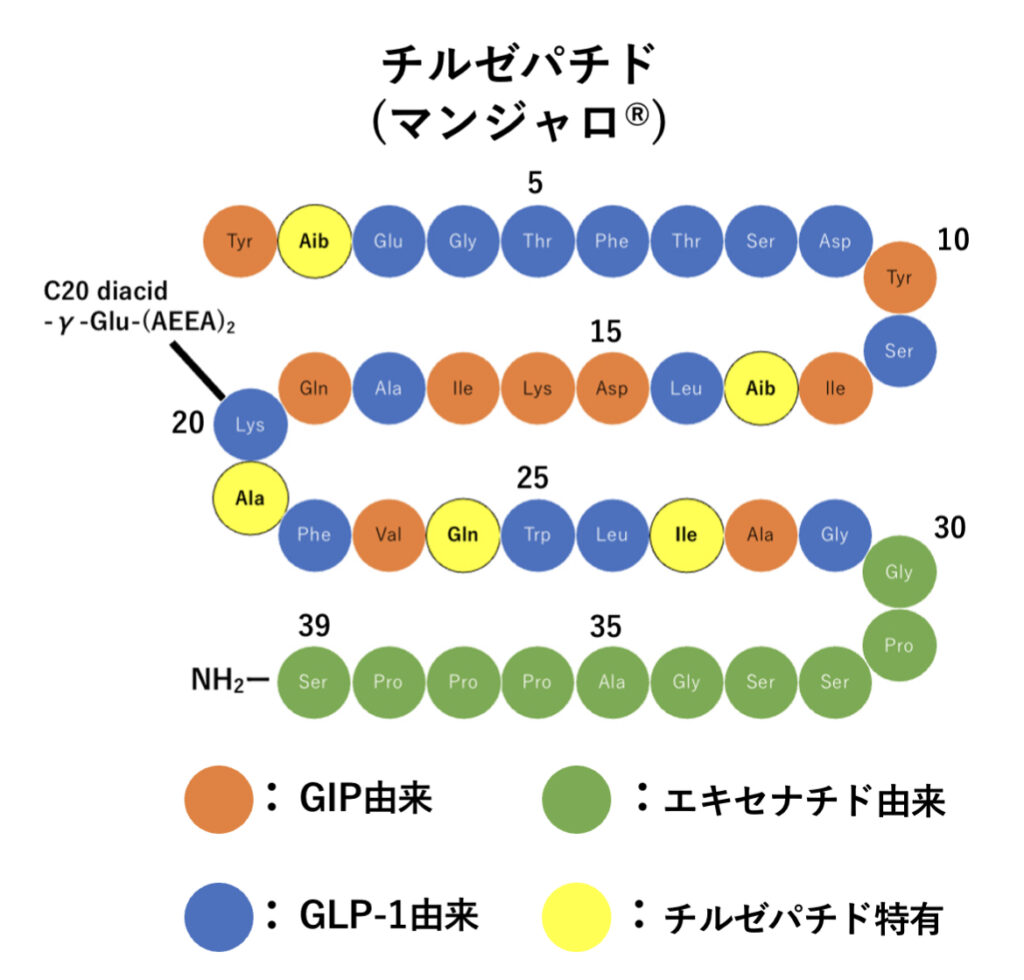
ここで、2、13番目のアミノ酸に導入されている「Aib」とは2-アミノイソ酪酸(2-aminoisobutyric acid)のことで、2-メチルアラニンです。
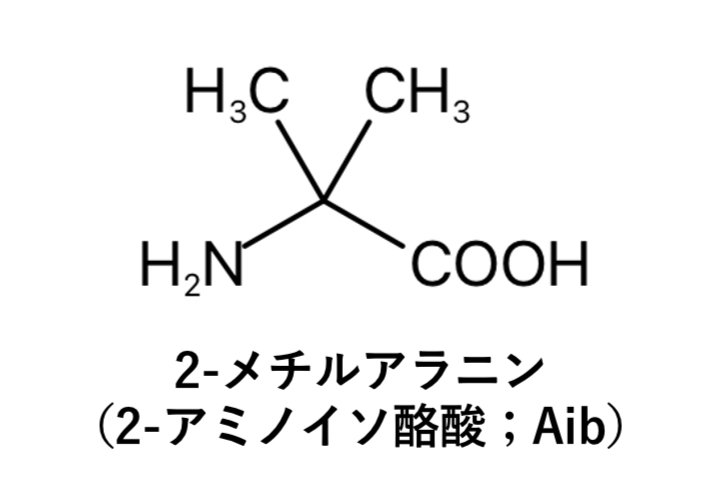
2-メチルアラニンはチルゼパチドがDPP−4によって分解されないよう2番目のアミノ酸に、さらにGIP活性を維持させるため13番目のアミノ酸にそれぞれ導入されています。
ちなみに、GLP-1受容体作動薬のセマグルチド(オゼンピック®︎、リベルサス®︎)の2番目のアミノ酸にも、同じ理由でDPP-4による分解防止のためAibが導入されています。
チルゼパチド の脂肪酸側鎖と役割
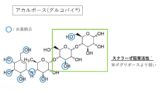
チルゼパチドの20番目のアミノ酸であるリシン(Lys)には、下図の脂肪酸が側鎖として付加され、アルブミンに結合しやすく半減期が長くなります。
これにより週1回の投与で効果を発揮するようになっているのです。
(※図のリシンはチルゼパチドのリシンです)
アルブミンの結合サイト(ⅠとⅡ)内部は疎水性アミノ酸残基のポケット、入り口に塩基性アミノ酸残基を持つため、疎水性が高くカルボキシ基で酸性を示す脂肪酸と結合しやすいのです。
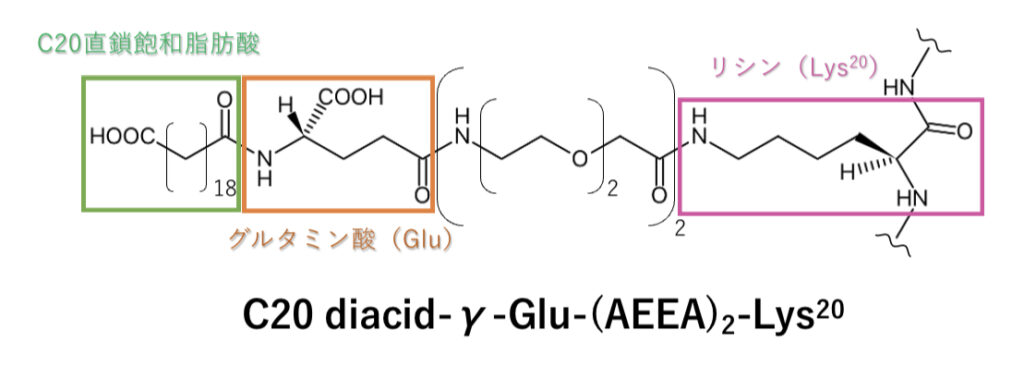
アルブミンと結合しているうちはチルゼパチドの代謝・分解が進まないので、結果的に半減期が延長します。
半減期を延長させるために脂肪酸を付加するのは効果的ですが、炭素鎖が短過ぎるとアルブミンへの結合親和性が低下し、逆に長過ぎると立体障害となります。
そのため、Lys20に付加する脂肪酸は炭素数16〜20くらいが良いとされています。
従来のGLP-1受容体作動薬でも、アルブミンとの結合親和性を高めるため、リラグルチド(ビクトーザ®︎)ではC16脂肪酸、セマグルチドではC18脂肪酸がペプチド構造に付加されているのです。
チルゼパチド のペプチド構造活性相関
ここからもう少し細かくアミノ酸の構造活性相関を確認してみます。
主なものを下の表にまとめてみました。
| No. | アミノ酸残基 | GIP活性 | GLP−1活性 | 作用・効果 |
| 1 | Tyr | ↑↑ | ↓ | GIP活性に必須 |
| 2 | Aib | ↑ | ↑ | DPP−4による分解防止 |
| 7 | Thr | ↓ | ↑ | |
| 10 | Tyr | ↑ | ↑ | |
| 12 | Ile | ↑ | ||
| 13 | Aib | ↑ | ↓ | |
| 14 | Leu | ↑ | ||
| 15 | Asp | ↑ | ||
| 16 | Lys | ↑ | ↓ | 塩基性のLysでGLP−1活性がわずかに低下 |
| 17 | Ile | ↑ | ||
| 18 | Ala | ↑ | ↑ | |
| 19 | Gln | ↑ | ||
| 20 | Lys | ↑ | ※C20脂肪酸はGIPに影響せずGLP−1活性を増大する | |
| 21 | Ala | ↓ | ↑ | 中性エンドペプチダーゼ (NEP;ネプリライシン)による分解防止 |
| 24 | Gln | ↑ | ↑ |
1番目のアミノ酸をTyrからHisに変えるとGIPRへの結合親和性が約1/20と大幅に低下してしまうため、ここはTyrが必須の構造となっています。
2番目のアミノ酸であるAibはセマグルチド(リベルサス®︎、オゼンピック®︎)にも導入されていて、いずれもDPP-4による分解を防止する重要な役割があります。
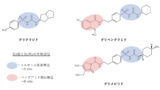
チルゼパチド と セマグルチド の構造は似ている?!
上でも少し説明しましたが、Aibや脂肪酸の付加といった修飾は従来のGLP-1受容体作動薬であるセマグルチド(オゼンピック®︎、リベルサス®︎)でも既に導入されていた手法でした。
セマグルチドのペプチド構造も確認してみましょう!
ここで、大変紛らわしいですが、GIPとGLP-1の活性部分のアミノ酸配列がズレており、アミノ酸残基を表す数字が6個分ズレています。
つまり、チルゼパチドで1番目のアミノ酸は、セマグルチドの7番目のアミノ酸に相当します。
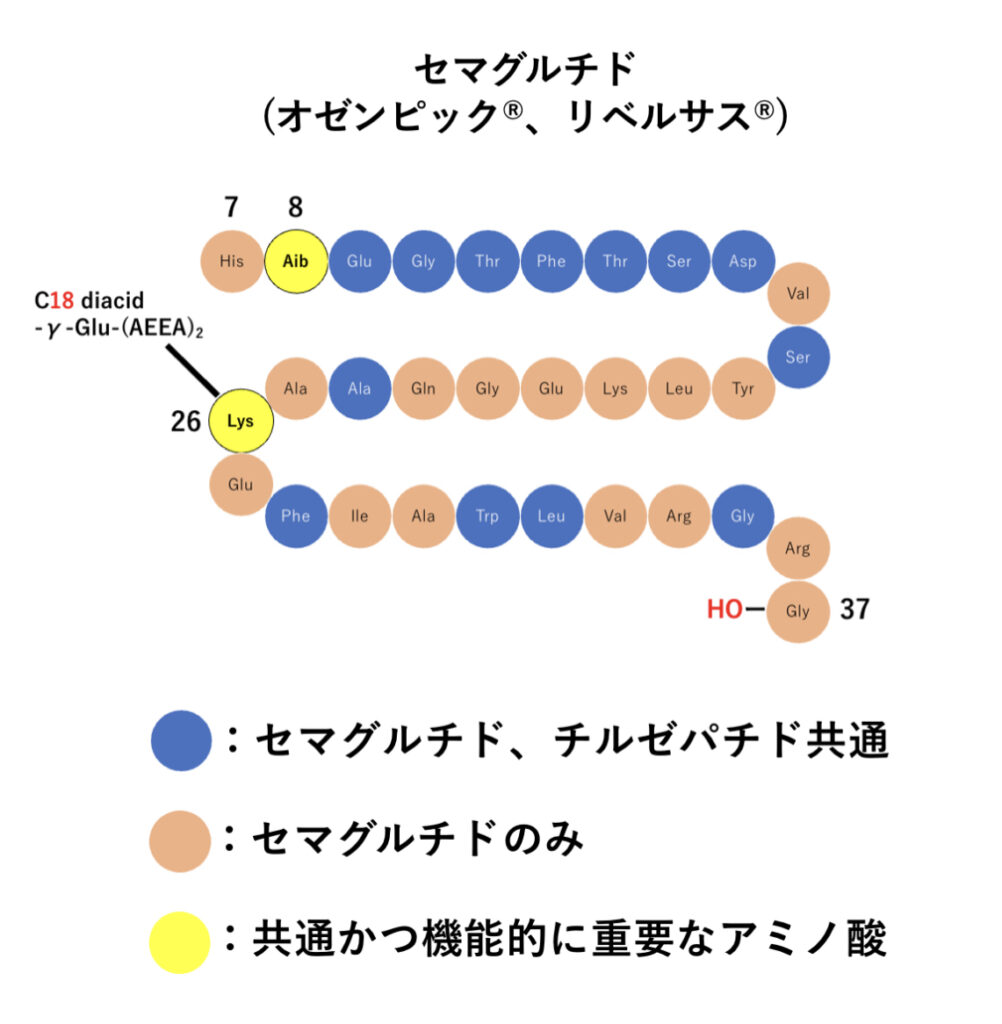
セマグルチド8番目(チルゼパチド2番目)のアミノ酸にAib、セマグルチド26番目(チルゼパチド20番目)のLysに脂肪酸側鎖が導入されているのは同様ですね!
このようにセマグルチドとチルゼパチドでは同様の修飾がされ、AibでDPP-4による分解防止、脂肪酸側鎖でアルブミンへの結合促進という役割を持っています。
まとめ
チルゼパチドのアミノ酸配列の大きな特徴は以下の3点です。
- ①GIPをもとに創製
- ②C-末端配列がエキセナチド(バイエッタ®︎)由来
- ③Aib、脂肪酸側鎖はセマグルチドとほぼ同じ
ペプチド構造活性相関を見ても、GIPとGLP-1の活性が上手く残されていて非常に面白いですね!
あわせて読みたい記事
参考:
・Lijing Wang. Designing a Dual GLP-1R/GIPR Agonist from Tirzepatide: Comparing Residues Between Tirzepatide, GLP-1, and GIP. Drug Des Devel Ther. 2022.
・Jiandong Yuan et al. Molecular dynamics-guided optimization of BGM0504 enhances dual-target agonism for combating diabetes and obesity. Sci Rep. 2024.
・Bingfa Sun et al. Structural determinants of dual incretin receptor agonism by tirzepatide. Proc Natl Acad Sci U S A.2022.