カルシウム拮抗薬 その中でもジヒドロピリジン系と言われるグループに属する薬剤を化学構造の観点から比較してみようと思います。
カルシウム拮抗薬
カルシウム拮抗薬は主に以下の3つに分類できます。
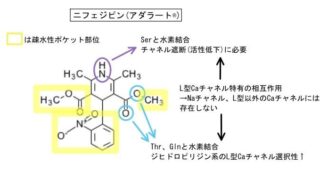
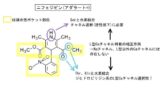
・ジヒドロピリジン(DHP)系・・・ニフェジピン(アダラート®︎)など
・フェニルアルキルアミン(PAA)系・・・ベラペミル(ワソラン®︎)
・ベンゾチアぜピン(BTZ)系・・・ジルチアゼム(ヘルベッサー®︎)
今回の記事ではDHP系Ca拮抗薬に絞って構造を見ていきます。
DHP系、PAA系、BTZ系の構造比較は過去記事をご参照ください↓
DHP系Ca拮抗薬は基本的にL型に作用し、副次的にN型やT型に作用するものがあります。
N型は交感神経終末,T型は心・腎、血管などに発現し,それぞれ心拍・脈拍,腎細動脈収縮による糸球体内圧上昇などに関与します。
L型以外にN型やT型を遮断する薬剤は反射性頻脈や腎糸球体内圧を低下させタンパク尿の減少効果なども期待でき、またN型の遮断で細静脈が拡張するためL/N型は下肢浮腫を生じにくいとされています。
DHP系Ca拮抗薬は血管平滑筋の不活性なL型Caチャネルに作用し立体構造を変化させ、不活性な状態を維持することでCa2+の細胞内への流入を防いでいます。
分子機構的には、DHP系が作用してチャネル中心細孔のシンメトリーが崩れ、Ca2+の水和が弱まることでチャネルを通過できなくなると考えられています。
カルシウム拮抗薬 の 構造活性相関
・3、5–位の脂溶性up→阻害活性up
・左右非対称→阻害活性up
・1位–NH–、3or5位−COO–の水素結合が阻害活性に重要
などがあり,N型,T型に作用する薬剤では側鎖の脂溶性が重要との見方もありますが,未だはっきりしたことはわかっていません。
またCa拮抗薬で問題になりやすいグレープフルーツジュース(GFJ)のCYP(3A4)阻害による相互作用は,Pーgpの基質とオーバーラップしやすいことから,
・程よい極性
・高い疎水性(logP>5)
・芳香環
などが重要と考えられます。
薬剤やGFJによるCYPの阻害機構についてはコチラも。
cf. CYP阻害機構と薬の構造
ジヒドロピリジン系 カルシウム拮抗薬 の化学構造と比較
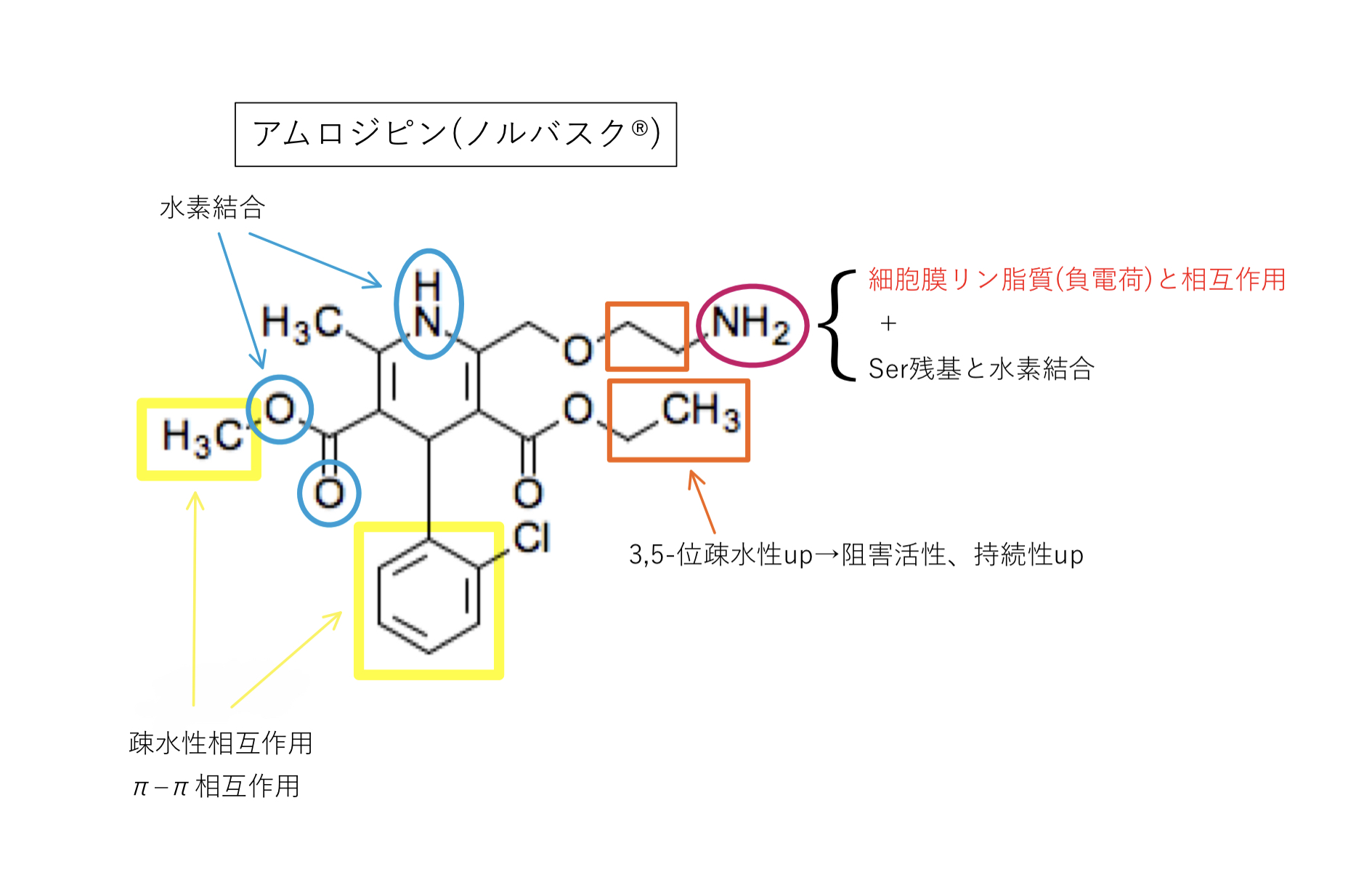
アムロジピン(ノルバスク®︎)
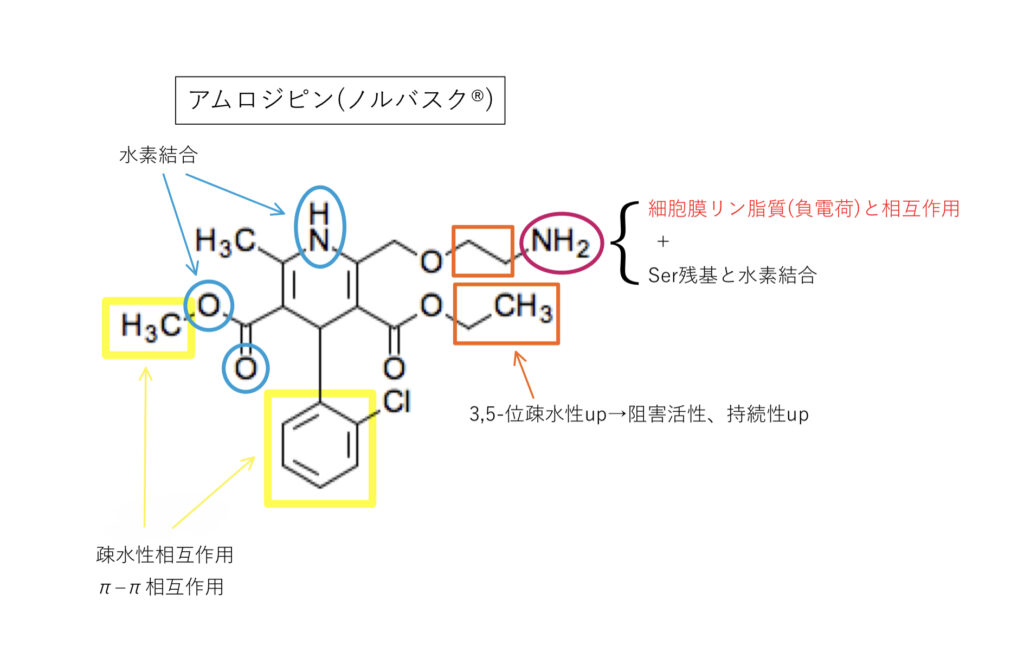
L型Caチャネルを遮断すると言われていますが,N型も阻害するという報告も多くあります。臨床的には意味のない程度とされていますが議論の余地はありそうです。
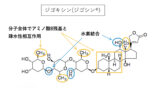
2位の第1級アルキルアミン
・生体内pHで陽イオン化し水溶性up
・陽荷電を持つアミノ基が細胞膜リン脂質(負電荷)に親和性up
などからCYPの代謝を受けにくく,DHP系の中でもGFJの影響が小さい(Cmax1.07〜1.15倍,AUC1.08〜1.16倍)薬剤とされ,作用時間の延長から半減期が長いのも特長です。
シルニジピン(アテレック®︎)
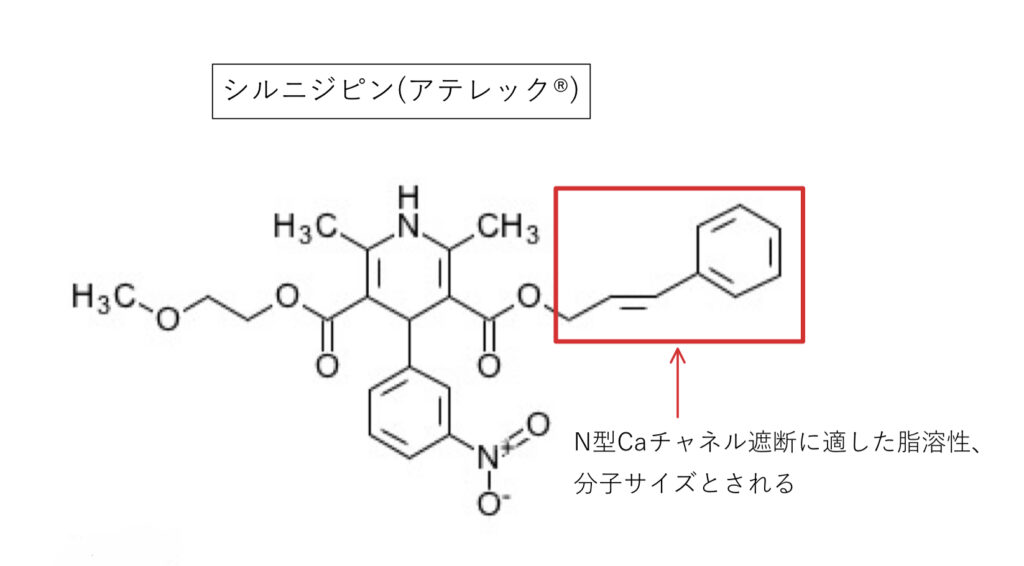
L+N型を遮断。基本の構造活性相関はアムロジピンと同様です。
側鎖に芳香環を持つシルニジピンはN型にフィットする化学構造で、他の大きな芳香環を持つDHP系(エホニジピン、アゼルニジピン)では3次元的にN型の結合部位には入り込めないと考えられています。
脂溶性が高いためCYPの影響も受けやすくGFJでAUC2.3倍。
エホニジピン(ランデル®︎)、アゼルニジピン(カルブロック®︎)
エホニジピン、アゼルニジピン共通
L+T型を遮断。
T型のファーマコフォアはまだ不明ですが、DHP系の3位置換基が重要で、光学異性体など立体的な分子角度も相互作用に重要なようです。
T型に特徴的な2つのAsp残基がアミノ基と相互作用、疎水性ポケットにフィットするためにも疎水性が高く適切な分子サイズが必要と考えられます。
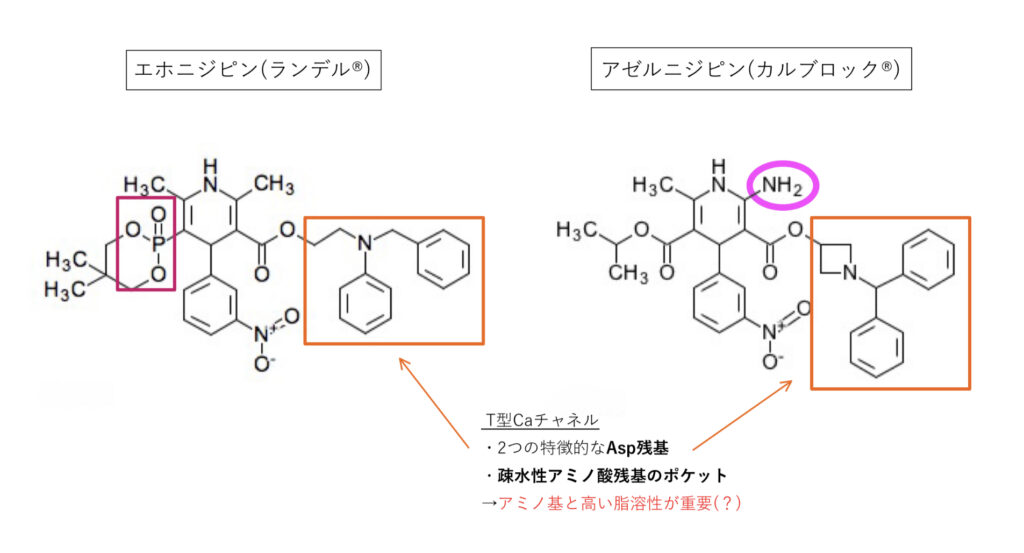
エホニジピン
ホスホン酸が特徴的で、これもT型への選択性に影響している可能性もあるようですがはっきりしたことはわかっていません。
ただ極性と脂溶性が高いため、細胞膜に取り込まれやすく作用時間も長くなるという特長があります。
GFJによりCmax1.26〜1.55倍,AUC1.7倍。
アゼルニジピン
2位にもアミノ基があり、緩徐な降圧効果と持続時間の延長を期待して開発されています(ここのファーマコフォアは不明)。
脂溶性が高く血管組織への選択性も向上していますが,CYPの影響はその分受けやすくなり,GFJでCmax2.54倍,AUC3.3倍。
ベニジピン(コニール®︎)
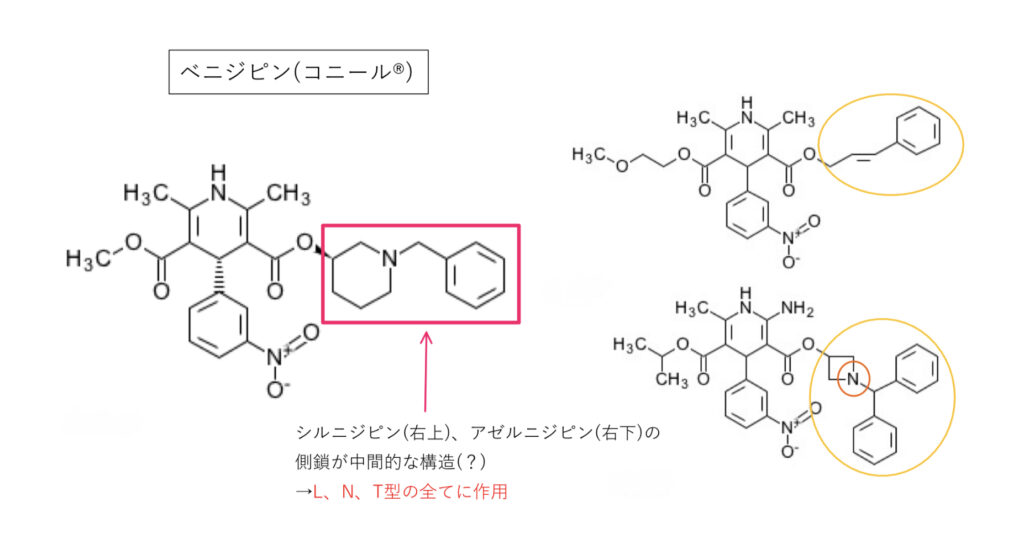
L+N+T型を遮断。側鎖(アミノ基+芳香環+分子サイズ)がシルニジピンとアゼルニジピンの中間的な構造になっていることで,N,T型にも作用すると考えられます。
GFJによりCmax1.7倍,AUC1.6倍。
最後に
DHP系 カルシウム拮抗薬 のチャネル選択性は3or5位側鎖の脂溶性と分子サイズが重要
構造活性相関的には、水素結合や脂溶性側鎖の疎水性相互作用、左右非対称性や分子サイズが阻害活性の増強と作用の持続時間に影響していて,GFJの影響もおおよそ特徴を反映しているように思います。
このように化学構造を見てみると、L型にしか作用しないと言われているような薬剤でもN型、T型に作用する可能性はあります。
ただ臨床的に意味のあるほどの作用かどうかは各薬剤について確認しなければなりません。
DHP系 カルシウム拮抗薬 はミネラルコルチコイド受容体(MR)拮抗作用を持つ?!
これはMR拮抗薬と化学構造的に一部重なることが理由と考えられていて、N、T型は副腎でのアルドステロン分泌抑制作用も認められています。
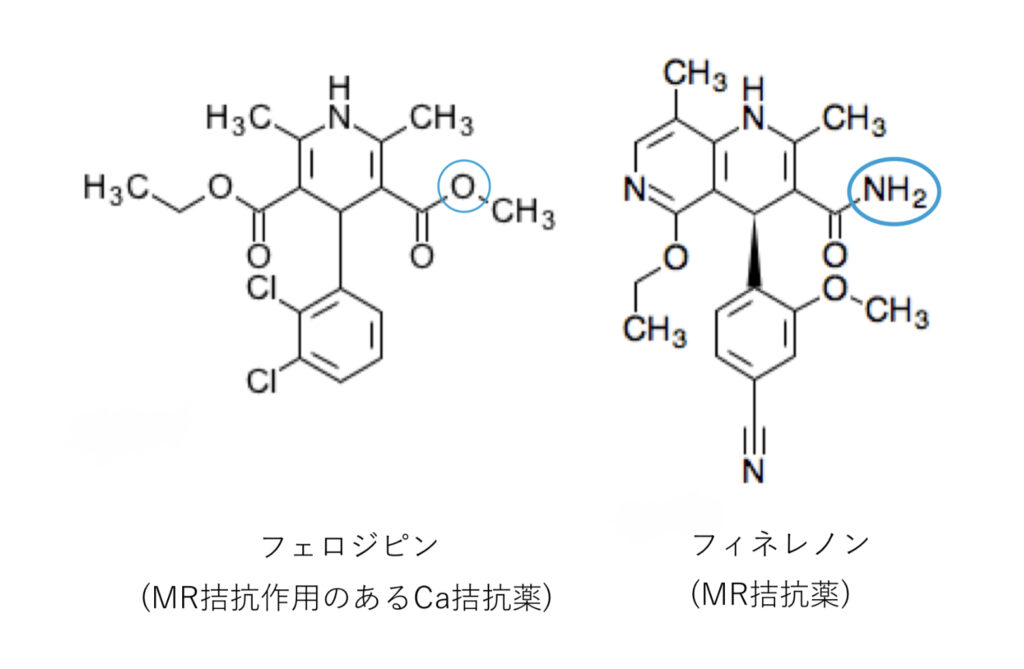
MR拮抗薬のフィネレノン(2022年4月現在、日本でも承認)の構造式を見ると、MR拮抗作用を持つとされるDHP系Ca拮抗薬(フェロジピン)に非常に似ていることがわかります。
MR拮抗作用にはSer810との水素結合が重要とされているので、何か相関があるかもしれませんね。
cf. MR拮抗薬の構造と特徴
DHP系Ca拮抗薬のファーマコフォアの情報はあまり出ていないので、今回はL、N、T型の選択性に影響のある構造・置換基について考察してみました。
参考・オススメ図書
医薬品構造化学
おそらく僕の中で最もオススメの書籍です!
化学構造と薬理作用の関係(構造活性相関)やファーマコフォア(立体構造や相互作用)など、目から鱗の情報が満載です。
化学構造の奥深さを大変実感できる内容です。
僕のブログのメインテーマ「化学構造と特徴」でもかなり多くの部分で参考になりました。
化学構造と薬理作用
化学構造と薬理作用の関係を解説した書籍です。
構造活性相関やファーマコフォアの情報、収載されている薬剤の種類も比較的豊富で、薬剤の基本骨格をある程度網羅的に見るのに良いです。
ジヒドロピリジン系Ca拮抗薬の構造活性相関も載っています。
併せて読みたい記事
- β遮断薬(βブロッカー)の化学構造と特徴〜構造式から薬剤を比較する〜
- アンギオテンシン変換酵素(ACE)阻害薬の化学構造と特徴〜構造式から薬剤を比較する〜
- アンギオテンシンⅡ受容体拮抗薬(ARB)の化学構造と特徴〜構造式から薬剤を比較する〜
- Ca拮抗薬(DHP系、BTZ系、PAA系)の化学構造と特徴〜構造式から薬剤を比較する〜
- ミネラル(鉱質)コルチコイド受容体拮抗薬の化学構造と特徴〜構造式から薬剤を比較する〜
参考:
・Structural Basis of the Modulation of the Voltage-Gated Calcium Ion Channel Ca v 1.1 by Dihydropyridine Compounds. Shuai Gao, Neing Yan. Angew Chem Int Ed Engl. 2021 Feb 8;60(6): 3131-3137.
・Synthesis, Evaluation of Pharmacological Activity, and Molecular Docking of 1,4-Dihydropyridines as Calcium Antagonists. Moataz Ahmed Shaldam, et al. Chem. Pharm. Bull. 64, 297–304 (2016).
・A number of marketed dihydropyridine calcium channel blockers have mineralocorticoid receptor antagonist activity. Jessica D Dietz, et al. Hypertension. 2008 Mar;51(3):742-8.
・Structural basis for inhibition of a voltage-gated Ca 2+ channel by Ca 2+ antagonist drugs. Lihg Tan, et al. Nature. 2016 Sep 1;537(7618):117-121.
・Distinct properties of amlodipine and nicardipine block of the voltage-dependent Ca2+ channels Cav1.2 and Cav2.1 and the mutant channels Cav1.2/dihydropyridine insensitive and Cav2.1/dihydropyridine sensitive. Min Lin, et al. Eur J Pharmacol. 2011 Nov 16;670(1):105-13.
・A region of N-type Ca(2+) channel critical for blockade by the dihydropyridine amlodipine. Yuriko Miyashita, et al. Eur J Pharmacol. 2010 Apr 25;632(1-3):14-22.
・Selectivities of Dihydropyridine Derivatives in Blocking Ca2+ Channel Subtypes Expressed in XenopusOocytes. Taiji Furukawa, et al. Journal of Pharmacology and Experimental Therapeutics November 1999, 291(2) 464-473.
・The structure–activity relationship study on 2-, 5-, and 6-position of the water soluble 1,4-dihydropyridine derivatives blocking N-type calcium channels. Takashi Yamamoto, et al. Bioorganic & medical Chemistry Letters. 1September 2008, Pages 4813-4816.
・Evaluation of the inhibitory effect of dihydropyridines on N-type calcium channel by virtual three-dimensional pharmacophore modeling. Ogihara Takuo, et al. Arzneimittelforschung. 2009;59(6):283-8.
・The evaluation of the N-type channel blocking properties of cilnidipine and other voltage-dependent calcium antagonists. Alexander Nap, et al. Fundum Clin Pharmacol. 2004 Jun;18(3):309-19.
・Structural basis for efonidipine block of a voltage-gated Ca 2+ channel. Fuyan Xu. et al. Biochem Biophys Res Commun. 2019 Jun 4;513(3):631-634.
・Kinetics of binding of membrane-active drugs to receptor sites. Diffusion-limited rates for a membrane bilayer approach of 1,4-dihydropyridine calcium channel antagonists to their active site. D G Rhodes, et al. Mol Pharmacol. 1985 Jun;27(6):612-23.
・持続型カルシウム拮抗薬アゼルニジピン(カルブロック®︎)の薬理特性と臨床効果 佐田登志夫,他 日薬理誌(Folia Pharmacol. Jpn.)122,539~547(203)
・T型Caチ ャネル遮断薬エホニ ジピンによる心房電気的 リモデリングの抑制 大橋成孝,他 JPN. J. ELECTROCARDIOLOGY Vol. 23 No. 4 2003.
・大日本住友製薬 医療情報サイト カルグレ
・グレープフルーツジュースによる薬物相互作用 北村正樹 景山茂 耳展42: 4; 430~433,1999
・Synthesis and evaluation of 1,4-dihydropyridine derivatives with calcium channel blocking activity. Chris Bladen, et al. Pflugers Arch. 2014 Jul;466(7):1355-63.
・Molecular simulations study of novel 1,4-dihydropyridines derivatives with a high selectivity for Cav3.1 calcium channel. Xiaoguang Liu, et al. Protein Sci. 2015 Nov; 24(11): 1737–1747.
・The Expanding Role of Pyridine and Dihydropyridine Scaffolds in Drug Design. Yong Ling, et al. Drug Des Devel Ther. 2021; 15: 4289-4338.
・Enantioselective Total Synthesis of (-)-Finerenone Using Asymmetric Transfer Hydrogenation. Andreas Lerchen, et al. Angew Chem Int Ed Engl. 2020 Dec 14;59(51): 23107-23111.
・Finerenone Impedes Aldosterone-dependent Nuclear Import of the Mineralocorticoid Receptor and Prevents Genomic Recruitment of Steroid Receptor Coactivator-1. Larbi Amazit, et al. J Bio Chem. 2015 Sep 4;290(36):21876-89.